トップページ > 診療科・部門 > 予防接種支援センター > 医療従事者向けワクチン情報 > 狂犬病の予防について
狂犬病の予防について
更新日:2019年5月
狂犬病は、1956年を最後に人での国内感染症例は報告されておらず、動物での感染報告も1957年が最後であることから、国内での発生を認めていない。一方で、依然として世界各地で広く流行を認め、致命率の高い感染症であり、2006年には国内でもフィリピンで犬咬傷により感染した輸入症例が2例報告されている。近年、国内外での海外渡航者数は著しく増加していることから、感染リスク地域の出入国者数も増加している。国内では、複数のワクチン製剤が流通していることから、医療従事者が適切な情報提供及び診療を提供するために必要となる一般的な医療情報をここに記載することとする。
狂犬病の疫学情報1-2)
- 狂犬病は、150か国以上で感染のリスクがある。
- ワクチンの接種により予防が可能だが、発症した場合には非常に死亡率の高いウイルス感染症。
- 人が狂犬病に感染して死亡する症例の、ほとんどが犬から感染している。
- 専門家による報告によると年間で推計59,000人が死亡しており、その感染のほとんどがアジア(約37,000人)とアフリカ(約21,500人)で報告されている。
- 感染リスクの高い年齢は、15歳未満の小児で、動物に咬まれる人の約4割を占めると推定される。
- 狂犬病の疑いがある動物と接触した場合には、直ぐに石鹸と水でよく傷を洗い、医療機関を受診することが大切。
- 世界保健機関(WHO)、国際獣疫事務局(OIE)、国際連合食糧農業機関(FAO)および世界狂犬病予防連盟(GARC)は、「2030年までに人の狂犬病による死亡をゼロにする」ことを目標に掲げている。
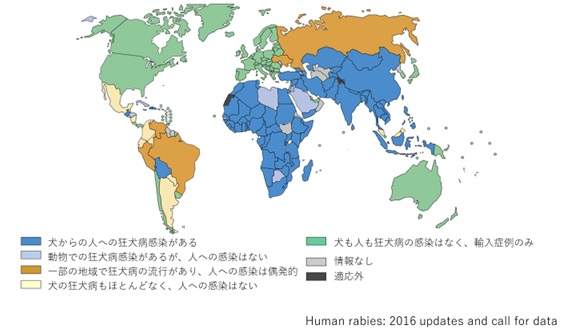
狂犬病のリスク地域2-4)
犬の狂犬病と犬から人への狂犬病の流行状況(2016年)
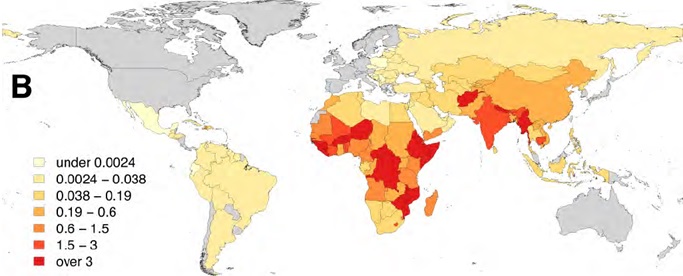
人口10万人当たりの狂犬病による死亡者数
国内で利用可能な狂犬病ワクチン5-8)
国内で流通する狂犬病ワクチンは国内承認されたKMバイオロジクスの製造する組織培養不活化狂犬病ワクチンに加えて、2019年3月にGSKの製造する狂犬病ワクチン、ラビピュール筋注用が製造販売承認され、7月26日に国内での販売が開始された。また、これまで、国内でKMバイオロジクスの製造する狂犬病ワクチンの生産量が年間4~5万本程度と供給量に制限があることから、2006年12月8日に狂犬病ワクチンを、流行地域からの帰国者で犬等に咬まれた者、狂犬病の流行地域に渡航する者で犬等に接触する可能性が高い者に優先的に接種すること等を示唆する通知(医政経発第1208004号)が発出される等の問題があり、薬監証明制度に基づき、海外から医師個人により輸入された国内未承認のワクチンも広く流通している。
狂犬病ワクチンの種類(2019年5月時点、Verorabは薬監証明制度による使用に限られる)
| ワクチン名 | 組織培養不活化 狂犬病ワクチン | ラビピュール筋注用 | Verorab® (国内未承認) |
|---|---|---|---|
| 製造会社 | KMバイオロジクス | GSK | Sanofi Pasteur |
| 国内承認 | 国内1980/6/10 | 2019/3/26 | 承認なし |
| 薬価収載 | 11,302円/瓶 | 11,867円/瓶 | なし |
| WHO 事前承認 |
承認なし | 2005/6/22 | 2002/3/13 |
| 投与経路 | 皮下注射 | 筋肉注射 | 筋肉注射 |
| 投与量 | 1.0ml | 1.0ml | 0.5ml |
| 内容量 | 不活化狂犬病ウイルス(HEP Flury株)を参照品と同等以上 | 不活化狂犬病ウイルス2.5 units/mL、サッカロース、残留テトラサイクリン及びネオマイシン | 不活化狂犬病ウイルス2.5 units/mL、ヒトアルブミン、マルトース含有、残留ネオアイシン |
| 回数 (曝露前) |
1.0mLを1回量として、4週間隔で2回皮下注射し、更に、6~12箇月後1.0mLを追加する。 | 1.0mLを1回量として、2回目を7日後、3回目を21日後または28日後に接種する。 | 0.5mLを1回量として、2回目を7日後、3回目を21日後または28日後に接種する。 |
| 回数 (曝露後) |
1.0 mLを1回量として、その第1回目を0日とし、以降3、7、14、30及び90日の計6回皮下に注射する。 | 1.0 mL を 1 回量として、適切な間隔をおいて 4~6 回*筋肉内に接種する。 | 0.5mL を 1 回量として、適切な間隔をおいて 5回筋肉内に接種する。 |
* 4 回接種: 0(接種部位を変えて、2 箇所に 1 回ずつ、計 2 回)、7、21 日
5 回接種: 0、3、7、14、28 日
6 回接種 0、3、7、14、30、90 日
狂犬病曝露後予防の適応について9-10)
| 曝露のカテゴリー | 狂犬病の感染が否定できない動物 | 曝露後予防の推奨 |
|---|---|---|
| カテゴリー1 | 動物に触れたり、餌をやったり、無傷の皮膚をなめられる(曝露なし) | なし |
| カテゴリー2 | 皮膚を直接軽く咬まれる、出血はないが皮膚に擦り傷ができる(曝露) | 直ちに狂犬病ワクチンによる曝露後予防を開始するが、咬んだ動物が10日間の観察期間後も健康である場合、適切な検査による評価で感染がないことが証明された場合には治療を中止する。コウモリとの曝露が関与している場合にはカテゴリー3として扱う。 |
| カテゴリー3 | 1回以上の咬傷または引っ掻き傷、動物の唾液との粘膜または傷との接触、コウモリとの直接接触による曝露(濃厚曝露) | 直ちに狂犬病ワクチンによる曝露後予防を開始し、狂犬病免疫グロブリンの注射(国内未承認)を暴露後予防の開始後できるだけ早く投与する(予防接種開始から7日間以内)。咬んだ動物が10日間の観察期間後も健康である場合、適切な検査による評価で感染がないことが証明された場合には治療を中止する。 |
WHO Position Paperによる推奨対応
- 咬傷部分は大量の水と石鹸を使いよく洗浄する
- カテゴリー3の曝露では、既に時間が経過していても接種を開始すべき。ただし、1年以上経過してからの発症は稀であることから、ワクチン供給に制限がある場合には1年以内の感染予防を優先する。
- 2回以上の曝露前接種があれば、カテゴリー3でも免疫グロブリン注射は適応とならない
- 曝露前接種の完了から3月以内の曝露の場合は、曝露後予防の接種は不要
- 曝露前接種の完了から3か月以降の曝露後接種は筋肉注射の場合0, 3日の2回接種
- 犬、猫、フェレットが10日以上健康であれば曝露後接種を中止して良い
- 狂犬病に感染した動物のミルクや肉を食べても曝露後接種は不要
- 免疫グロブリンは曝露後接種開始7日後以降には不要
- コウモリとの接触があれば、カテゴリー3として対応
特殊な対応
同一の狂犬病ワクチン製剤が入手できない場合の対応
- 異なるワクチン製剤を代用して予防接種を行った場合の有効性(免疫原性)に関するデータは限られていることから、狂犬病の致命率の高さを考慮し、同一の狂犬病ワクチン製剤が入手できない場合には、原則、必要な回数の予防接種を完了できる同一製剤での接種し直しを考慮する
- 曝露のカテゴリー、曝露源の動物の状態による曝露後予防の適応は再度確認する
- ワクチン製剤の安定的な供給が難しい場合には、接種を完了するために必要な本数のワクチンを事前に確保しておく等の対応が望ましい
- 国内で承認のある2剤の狂犬病ワクチンは、接種経路の違いがあるものの、同じ方法により製造されている(精製ニワトリ胚細胞培養狂犬病ワクチン)こと、少数ながらこの2剤間で製剤を変更しても発症予防効果を確認できたデータが存在する(下記参照)
- 米国CDCによれば、既に曝露前予防接種を完了している場合の曝露後予防(2回接種)では使用する狂犬病ワクチンは曝露前接種で用いたワクチン製剤と同一である必要はない11)
- WHOが推奨する狂犬病ワクチンを用いた対応と日本国内で承認されている狂犬病ワクチンの使用方法が異なることを理解の上、曝露状況や予防接種の既往・タイミング等から感染及び発症のリスクを総合的に評価し、被接種者とよく相談の上で最終的な対応方針を決定する
交差免疫に関するデータ
- 曝露後予防でラビピュールを1~4回接種後にKMバイオロジクスによる組織培養不活化狂犬病ワクチン(KMBワクチン)で接種を継続して計5回の曝露後予防を実施した22例の検討において、全例で接種完了から14日後に十分な免疫獲得を認めた。ただし、ラビピュール1-2回接種後にKMBワクチンで計3回を接種した7日後時点では、12例中2例で抗体価がWHO が定める発症防御レベル(0.5IU/mL)に達せず、KMBワクチンのみで3回接種を行った群(62例中3例)と比較して、0.5IU/mL未満の割合が高かったとする報告がある12)。
- 曝露後予防でラビピュールによる接種を開始後、KMバイオロジクスによる組織培養不活化狂犬病ワクチン(KMBワクチン)で接種を継続して計5回の曝露後予防を実施した3例の検討において、全例で合計4回の接種から2週間後以降に、0.5 IU/mL以上の十分な抗体価の上昇が確認できた13)。
- 狂犬病の曝露後予防中に、接種経路(全て筋肉注射か皮内注射)やワクチン製剤が途中で変更された90例の曝露後予防について前向きに免疫原性を検討した報告では、全例で接種開始から14日目時点でWHO が定める発症防御レベル(0.5IU/mL)以上に抗体価が上昇した14)。
- 精製ニワトリ胚細胞培養狂犬病ワクチン(PCECV)とヒト二倍体細胞培養狂犬病ワクチン(HDCV)との交差免疫を、追加接種で評価した報告によると、抗体価の上昇に有意差を認めず、交差免疫があるとされる。また、この2製剤を承認している米国では、専門家の意見として、互換性があるものとして対応して良いとの情報をCDCが紹介している15-16)。
Reference:
- WHO fact sheet, Rabies
- PLoS Negl Trop Dis. 2015 Apr 16;9(4):e0003709.
- Wkly Epidemiol Rec. 2017 Feb 17;92(7):77-86.
- Gov UK: Guidance, Rabies risks in terrestrial animals by country (Updated 1 May 2019)
- PMDA: 乾燥組織培養不活化狂犬病ワクチン(組織培養不活化狂犬病ワクチン)
- PMDA: 乾燥組織培養不活化狂犬病ワクチン(ラビピュール筋注用)
- WHO: Rabies (1 dose vial) (Verorab)
- 国立感染症研究所・厚生労働省健康局結核感染症課: IASR. 2007 Mar; 28: 75-76.
- WHO: WHO expert consultation on rabies: third report, 2018.
- Vaccine. 2018 Sep 5;36(37):5500-5503.
- CDC: Travelers' Health, Chapter 3, Rabies
- Kansenshogaku Zasshi. 2002 Oct;76(10):882-7.
- J Infect Chemother. 2019 May 30. pii: S1341-321X(19)30137-0.
- Hum Vaccin Immunother. 2014 May; 10(5): 1354–1358.
- Vaccine. 2000 Dec 8;19(9-10):1055-60.
- Immunization Action Coalition: Ask the Expert, Rabies.